Elektron
Was ist ein Elektron?
Ein Elektron ist ein negativ geladenes subatomares Teilchen, das entweder an ein Atom gebunden oder frei (nicht gebunden) sein kann. Ein an ein Atom gebundenes Elektron ist eine der drei primären Teilchenarten innerhalb des Atoms – die anderen beiden sind Protonen und Neutronen.
Protonen und Elektronen bilden zusammen den Atomkern. Ein Proton hat eine positive Ladung, die der negativen Ladung des Elektrons entgegenwirkt. Wenn ein Atom die gleiche Anzahl von Protonen und Elektronen hat, befindet es sich in einem neutralen Zustand.
Elektronen unterscheiden sich in vielerlei Hinsicht von anderen Teilchen. Sie befinden sich außerhalb des Kerns, haben eine wesentlich geringere Masse und weisen sowohl wellenartige als auch teilchenartige Eigenschaften auf. Ein Elektron ist auch ein Elementarteilchen, das heißt es besteht nicht aus kleineren Komponenten. Protonen und Neutronen bestehen vermutlich aus Quarks und sind daher keine Elementarteilchen.
Schalen, Unterschalen und Orbitale
In den Anfängen der Atomforschung glaubten Wissenschaftler, dass die Elektronen eines Atoms den Kern in kugelförmigen Bahnen in bestimmten Abständen umkreisen, ähnlich wie Planeten eine Sonne umkreisen. In diesem Modell – dem sogenannten Bohrschen Atommodell – enthalten die Bahnen, die am weitesten vom Kern entfernt sind, die größte Energiemenge. Wenn ein Elektron von einer Umlaufbahn mit höherer Energie auf eine Umlaufbahn mit niedrigerer Energie springt, gibt das Atom elektromagnetische Strahlung ab.
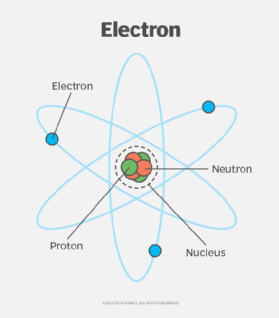
Das Bohrsche Atommodell gilt nicht mehr als zutreffend, insbesondere was die Umlaufbahnen der Elektronen um den Kern betrifft. Das Modell kann zwar immer noch nützlich sein, um die Grundlagen der Elektronenverteilung und der verschiedenen Energieniveaus zu verstehen, es berücksichtigt jedoch nicht die Komplexität dieser Verteilung und die Art und Weise, wie Elektronen den Raum um den Kern herum bewohnen, gemäß der aktuellen Quantentheorie.
Die Bewegung der Elektronen wird durch die Berechnung der Wahrscheinlichkeit bestimmt, mit der sich Elektronen in bestimmten Bereichen des Raums um den Atomkern befinden – und nicht durch die Annahme fester Bahnen. Die mathematisch definierten Bereiche basieren auf drei Strukturmustern:
- Schalen. Das Konzept der Schale stammt aus dem Bohrschen Atommodell, obwohl sich die Theorie um die Schalen weiterentwickelt hat. Physiker gehen heute davon aus, dass eine Schale ein Wahrscheinlichkeitsbereich ist, der den Kern umgibt. Ein Atom kann je nach Atomart bis zu sieben Elektronenschalen enthalten. Die Schalen existieren auf verschiedenen Ebenen um den Kern herum. Die Schalen, die am weitesten vom Kern entfernt sind, haben die höchste Energiemenge und die am nächsten gelegenen die niedrigste. Jede Schale ist auf eine bestimmte Anzahl von Elektronen beschränkt, je nach ihrer Ebene und Konfiguration. Eine Schale kann eine oder mehrere Unterschalen enthalten, und eine Unterschale kann ein oder mehrere Orbitale enthalten.
- Unterschalen. Eine Unterschale ist eine Ansammlung von einem oder mehreren Orbitalen eines bestimmten Typs. Es gibt vier Arten von Orbitalen und folglich vier Arten von Unterschalen – bezeichnet als s, p, d und f, je nach ihren Orbitalen. Eine s-Unterschale enthält ein s-Orbital, eine p-Unterschale enthält drei p-Orbitale, eine d-Unterschale enthält fünf d-Orbitale und eine f-Unterschale enthält sieben f-Orbitale. Es wurde auch die Theorie aufgestellt, dass ein Atom eine g-Unterschale mit neun g-Orbitalen unterstützen kann.
- Orbitale. Ein Orbital ist ein speziell geformter Bereich des Raums um den Kern, in dem sich ein Elektron am wahrscheinlichsten befindet. Mit anderen Worten ist es der Bereich mit der höchsten Wahrscheinlichkeit (über 90 Prozent), das Elektron auf seiner Reise um den Kern zu enthalten. Ein Orbital kann die Form einer Kugel (s-Orbital), einer Hantel (p-Orbital) oder eine komplexere Form (d- und f-Orbitale) haben. Unabhängig von seiner Form kann ein Orbital maximal zwei Elektronen enthalten.
Die Schalen eines Atoms sind fortlaufend nummeriert, beginnend beim Kern und nach außen hin. Die Nummer einer Schale wird oft als ihr n-Wert bezeichnet. So könnte die dritte Schale beispielsweise als n=3 oder 3n bezeichnet werden. Manchmal werden auch Buchstaben verwendet, um die Schalen zu bezeichnen. Dazu gehören K, L, M, N, O, P und Q, wobei wieder vom Kern ausgehend gearbeitet wird. So kann beispielsweise die dritte Schale als M-Schale oder 3m bezeichnet werden.
Jede Schale enthält eine oder mehrere spezifische Arten von Unterschalen, die die maximale Anzahl von Elektronen bestimmen, die die Schale enthalten kann. So enthält beispielsweise die erste Schale (K) eine einzelne s-Unterschale, die nur ein s-Orbital umfasst. Daher kann die Schale maximal zwei Elektronen enthalten. Das bedeutet, dass ein Atom mit nur einer K-Schale auf zwei Elektronen beschränkt ist. Nur zwei Elemente, Wasserstoff und Helium, haben eine einzige Schale. Wasserstoff enthält nur ein Elektron und Helium zwei.
Die Unterschalen-/Orbitalanordnung variiert von Schale zu Schale und wird immer komplexer, bis zur fünften Schale, ab der die Komplexität abnimmt. So umfasst beispielsweise die zweite Schale (L) eine s-Unterschale und eine p-Unterschale. Die s-Unterschale enthält ein s-Orbital und die p-Unterschale enthält drei p-Orbitale. Das bedeutet, dass die Schale bis zu acht Elektronen aufnehmen kann.
Ein Atom mit einer L-Schale enthält jedoch auch eine K-Schale. Tatsächlich beginnt die L-Schale sich zu füllen, nachdem die K-Schale gefüllt ist. Das bedeutet, dass ein Atom mit einer L-Schale bis zu zehn Elektronen aufnehmen kann, da sowohl die K- als auch die L-Schale vorhanden sind. Lithium und Neon enthalten beispielsweise sowohl K- als auch L-Schalen. Ein Lithiumatom hat nur drei Elektronen, zwei in der K-Schale und eines in der L-Schale, aber ein Neonatom hat zehn Elektronen, zwei in der K-Schale und acht in der L-Schale.
Im Allgemeinen setzt sich dieses Muster für alle sieben Schalen fort, wobei die inneren Schalen zuerst mit Elektronen aufgefüllt werden, bevor die äußeren Schalen folgen. Dies ist jedoch nur eine Tendenz. Elektronen streben die stabilste Anordnung an, die in der Regel die inneren Schalen sind, aber es ist auch möglich, dass eine äußere Schale mit der Auffüllung mit Elektronen beginnt, bevor die untere Schale vollständig gefüllt ist.
Unabhängig von der Reihenfolge, in der sich die Schalen mit Elektronen füllen, bestimmen die Schalen selbst die maximale Anzahl an Elektronen, die sie basierend auf ihren Unterschalen und Orbitalen aufnehmen können. Alle Schalen außer der ersten enthalten eine p-Unterschale, nur die dritte bis sechste Schale enthalten d-Unterschalen und nur die vierte und fünfte enthalten f-Unterschalen. Alle sieben Schalen enthalten eine s-Unterschale.
Elektronen und Elektrizität
In elektrischen Leitern fließt Strom, wenn Elektronen von Atom zu Atom springen, während sie sich von negativen zu positiven elektrischen Polen bewegen. In Halbleitermaterialien entsteht Strom ebenfalls durch Elektronenbewegung, allerdings beruht die Bewegung auf Elektronenmangel in Atomen. Ein Atom mit Elektronenmangel in einem Halbleiter wird als Loch bezeichnet. In diesem Fall fließt der Strom von positiven zu negativen elektrischen Polen.
Die Ladung eines einzelnen Elektrons wird als elektrische Elementarladung bezeichnet. Es trägt eine negative Ladung, die gleich der positiven Ladung eines Protons oder Lochs ist, aber entgegengesetzt zu dieser. Die Menge der elektrischen Ladung wird jedoch in der Regel nicht an einem einzelnen Elektron gemessen, da diese Menge so gering ist.
Stattdessen ist die Standardeinheit der elektrischen Ladung das Coulomb (C). Ein Coulomb enthält etwa 6,24 x 1018 Elektronen. Die Ladung eines Elektrons (e) beträgt etwa 1,60 x 10-19 C. Die Masse eines ruhenden Elektrons (me) beträgt etwa 9,11 x 10-31 Kilogramm (kg). Wenn Elektronen auf nahezu Lichtgeschwindigkeit beschleunigt werden, wie in einem Teilchenbeschleuniger, haben sie aufgrund relativistischer Effekte eine größere Masse.









